生命的源泉
骨髓造血干细胞——从起源到未来的再生医学
一、 来源:从胚胎发生到骨髓定居
造血干细胞的发育是一个复杂的、多部位迁移的过程,其来源可分为胚胎期来源和成年后来源。
1. 胚胎期与胎儿期发育:一场“迁徙之旅”
骨髓中的造血干细胞并非原生于此,它们经历了一场漫长的旅程:
(1)卵黄囊阶段(胚胎早期): 在人类胚胎发育的第3周左右,最早的造血活动发生在卵黄囊。这里主要产生原始的、主要用于胚胎早期供血的有核红细胞。此时的造血祖细胞增殖能力有限。
(2)主动脉-性腺-中肾区(aorta-gonad-mesonephros,AGM)阶段(胚胎中期): 随后,造血干细胞的发生地点转移至胚胎内部的AGM。这里的AGM区域产生了具有长期、多系重建能力的确定性造血干细胞。这是成年机体造血系统的真正起点。
(3)胎儿肝/脾阶段(胎儿期): AGM区的HSCs通过血液循环迁移至胎儿肝脏和脾脏。这些器官成为胎儿中期的主要造血场所,HSCs在这里进行快速的扩增和分化,以满足胎儿快速生长的需求。
(4)骨髓定居阶段(胎儿晚期至出生后): 从胎儿晚期开始,HSCs开始向骨髓迁移。出生后,骨髓成为最主要的造血器官,承担起终生造血的职责。
2. 成年期来源:骨髓作为“大本营”
成年后,骨髓是HSCs的主要来源,特别是扁骨(如骨盆、胸骨、椎骨)和长骨(如股骨、胫骨)的近端。在稳态下,绝大多数HSCs处于静息状态,仅有一小部分周期性地进入细胞周期,以维持血液系统的稳定更新。当需要时(如失血、感染),它们会被迅速激活。
二、 分化:精密调控的“细胞谱系树”
造血干细胞最核心的特征是其多向分化潜能和自我更新能力。它们通过一个高度有序的分化,产生所有类型的血细胞。这个过程好比一棵不断分叉的树,HSCs是树根,最终成熟的血细胞是树叶。
主要分化路径:
1.第一步:命运抉择——淋系与髓系的分化
HSC首先分化为多能祖细胞,然后面临第一次主要命运抉择:是走向淋巴系祖细胞,还是髓系祖细胞。
(1)巨核细胞/红细胞祖细胞 → 血小板(来自巨核细胞碎片)和红细胞。
(2)粒细胞-单核细胞祖细胞 →
①髓系分支: 产生所有髓系细胞,包括中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞
②单核细胞 → 组织中的巨噬细胞和树突状细胞
(3)淋巴系分支: 产生所有淋巴细胞。
淋系祖细胞 →
①T细胞祖细胞 → 在胸腺中发育为成熟的T淋巴细胞
②B细胞祖细胞 → 在骨髓中发育为成熟的B淋巴细胞
③自然杀伤细胞
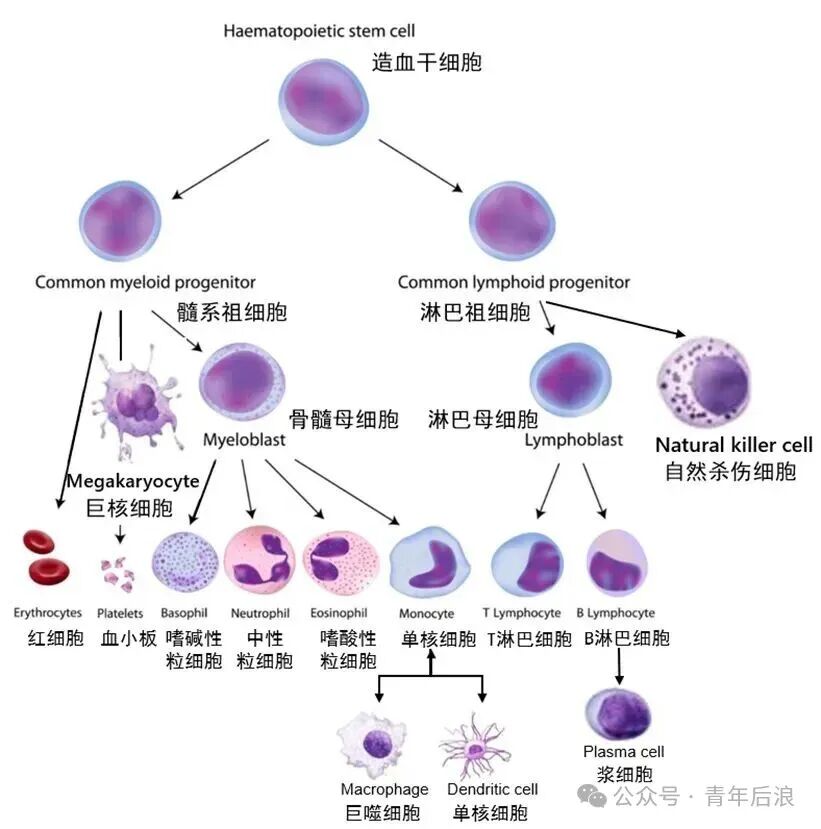
(HSCs分化示意图)
三、 分类:基于功能与潜能的精细划分
根据发育阶段、表面标志物和功能潜能,HSCs可以进行精细分类。
1. 按发育阶段分类
(1)胚胎性HSCs: 位于AGM区,具有极强的自我更新和增殖能力。
(2)胎儿期HSCs: 位于胎肝,处于高度增殖状态。
(3)成年期HSCs: 位于骨髓,大部分处于静息状态,稳态下增殖缓慢。
2. 按分化潜能分类(主要分类)
(1)长期造血干细胞: 是造血系统的“顶层管理者”。具有终生自我更新能力,负责维持整个造血系统的长期稳定。它们分裂缓慢,是移植后能够长期重建造血的细胞。
(2)短期造血干细胞: 由长期造血干细胞分化而来。具有多系分化潜能,但自我更新能力有限(只能维持数周至数月)。负责应对日常的血液更替需求。
(3)多能祖细胞: 已失去自我更新能力,但仍能分化为所有髓系和淋系细胞。是分化路径上的“部门经理”。
3. 按表面标志物分类(用于分离和鉴定)
这是实验研究和临床应用中至关重要的分类方式。最经典的人类HSCs表型是:
(1)CD34⁺:造血祖细胞的经典标志。
(2)CD38⁻:更原始的HSCs特征。
(3)CD90⁺ 和 CD45RA⁻:进一步富集HSCs。
(4)CD49f⁺ 和 CD150⁺:用于鉴定最原始的长期造血干细胞。
四、 未来展望:从基础生物学到再生医学的无限可能
对HSCs研究的深入,正在开启一个全新的再生医学时代。
1. 造血干细胞移植的优化与拓展
(1)来源拓展: 除了骨髓,外周血动员干细胞和脐带血干细胞已成为重要来源。未来,利用人多能干细胞定向诱导分化产生功能完整的HSCs,有望解决供体匮乏的难题。
(2)“即用型”产品: 通过基因编辑技术(如CRISPR-Cas9)制备通用型HSCs,可避免移植物抗宿主病,实现“现货”供应。
2. 基因治疗的革命
HSCs是离体基因治疗的理想载体。从患者体内取出HSCs,在体外进行基因校正后,再回输患者体内,可终身产生健康的血细胞,从而根治遗传性血液病。已成功应用: 针对重症联合免疫缺陷病、β-地中海贫血、镰状细胞病的基因疗法已获批上市,取得了治愈性效果。
3. 针对HSCs的疾病建模与药物筛选
利用患者来源的诱导多能干细胞(iPSCs)诱导分化为HSCs,可以在体外构建模型,用于研究血液病的发病机制,并高通量筛选治疗药物。
4. 超越造血:HSCs的潜在新功能
(1)免疫治疗的应用: HSCs可以作为载体,用于改造和生成通用型、即用型的CAR-T细胞,降低个体化制备的复杂性和成本。
(2)组织修复的潜能: 有研究表明,HSCs或其衍生物可能具有一定的跨系分化潜能,或通过分泌因子参与非造血组织的修复,如促进血管生成和神经再生,但这仍是探索中的领域。
